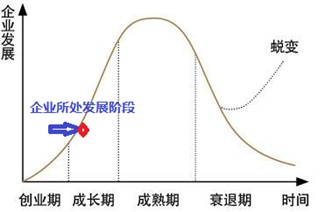
圖5 企業(yè)生命發(fā)展周期
組織對內(nèi)部運(yùn)營管理要求為:形成能夠有效支持到整合“新”資源、在“新”的環(huán)境中,“快速”、“高效”地達(dá)成目標(biāo)的運(yùn)作模式。
3. 尋找組織的價(jià)值點(diǎn)
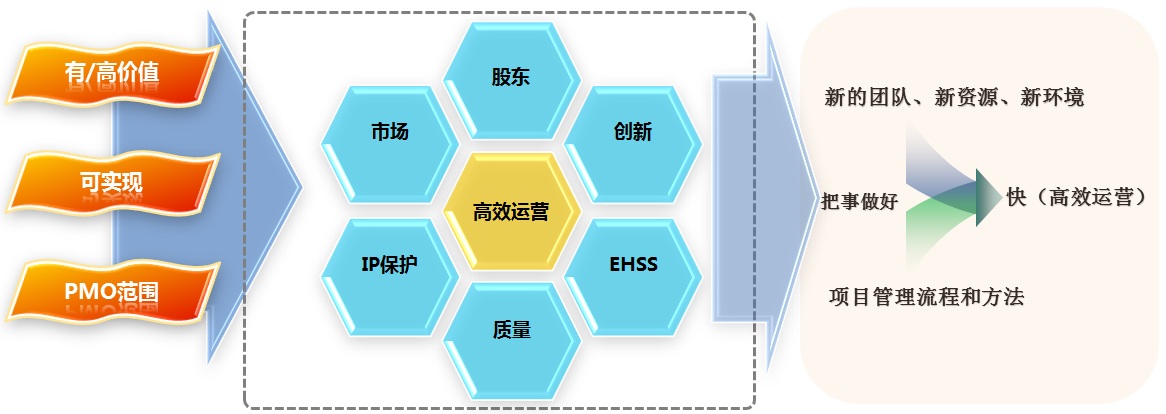
圖6 組織落地的價(jià)值點(diǎn)
尋找對組織有價(jià)值的運(yùn)營環(huán)節(jié)、區(qū)域,首先,要定義落地的價(jià)值點(diǎn)的衡量標(biāo)準(zhǔn)。PMO從三個方面進(jìn)行考慮。首先是對組織無價(jià)值、低價(jià)值、有價(jià)值且為高價(jià)值的運(yùn)營區(qū)域或者環(huán)節(jié)進(jìn)行區(qū)分,如果這些落地點(diǎn)落在無價(jià)值或者低價(jià)值區(qū),將不會對組織的運(yùn)營做出顯性、關(guān)鍵貢獻(xiàn)。其次,這些價(jià)值點(diǎn)是能夠?qū)崿F(xiàn)的。如果從資源或者PMO實(shí)現(xiàn)的角度不能實(shí)現(xiàn)或者實(shí)現(xiàn)難度很高,再有價(jià)值的落地點(diǎn)也會沒有意義。第三,這些價(jià)值的落地點(diǎn)必須是PMO當(dāng)前的工作范圍,也就是需要和PMO管轄的項(xiàng)目(集)相關(guān)。如果這些落地點(diǎn)雖然有高價(jià)值,但是不是項(xiàng)目(集)所涉及管理的范圍,屬于其他業(yè)務(wù)部門的業(yè)務(wù)范圍,價(jià)值的依賴性過多或者根本無關(guān),就很難體現(xiàn)PMO的相關(guān)作用。
如圖6所示,在覆蓋組織股東、市場、IP保護(hù)、質(zhì)量、EHSS(環(huán)境、健康、安全、安保)、創(chuàng)新等主要運(yùn)營環(huán)節(jié)中,選擇了“高效運(yùn)營”這個落地點(diǎn)。首先,該點(diǎn)與組織的主要運(yùn)營環(huán)節(jié)都相關(guān)。其次,在組織完成架構(gòu)建設(shè)后,“高效運(yùn)營”貫穿于組織整個生命周期中,屬于持續(xù)改進(jìn)的重要目標(biāo)和組成部分。因此選擇“高效運(yùn)營”作為落地點(diǎn)具有價(jià)值高、生命周期長且可實(shí)現(xiàn)的優(yōu)勢。
4. 規(guī)劃行動、實(shí)現(xiàn)價(jià)值
在開始規(guī)劃行動之前,需要對關(guān)鍵項(xiàng)進(jìn)行分析。這些關(guān)鍵項(xiàng)對PMO在組織中生存和發(fā)展至關(guān)重要。關(guān)鍵項(xiàng)包括:
1) 了解組織內(nèi)部門合作的本質(zhì)。
2) 優(yōu)化跨部門合作及與供應(yīng)商合作的方式。
3) 形成適合組織、組織適用的項(xiàng)目管理方法(論),結(jié)合PMI和V-Model在項(xiàng)目中平衡合規(guī)和效率的問題。
同時在GMP環(huán)境下,PMO需要解決三個層面的問題:
1) 原非GMP人員不理解項(xiàng)目中GMP要求。
2) GMP環(huán)境人員不理解項(xiàng)目管理的要求。
3) GMP環(huán)境中結(jié)合原有管理系統(tǒng)的利用和優(yōu)化 (如CC, Deviation,CAPA等)。
如何真正地規(guī)劃行動協(xié)助組織實(shí)現(xiàn)價(jià)值,如圖7所示。
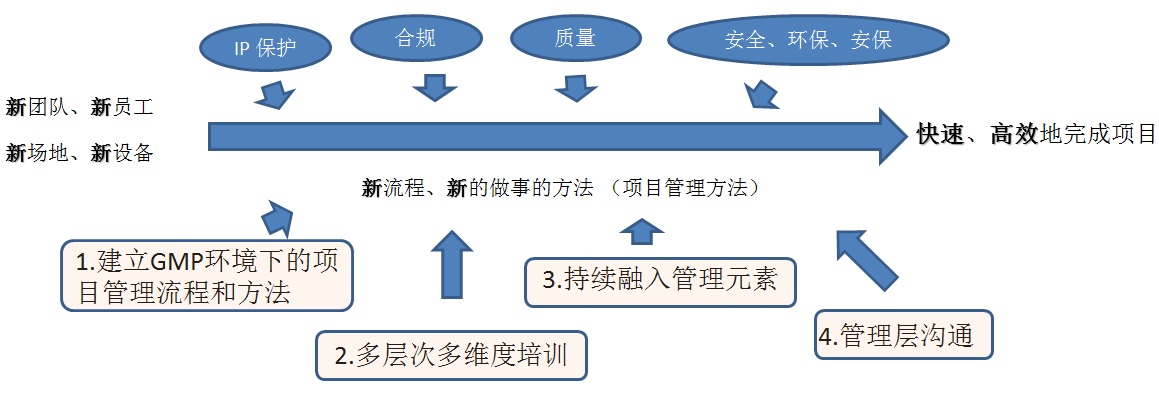
圖7 實(shí)現(xiàn)價(jià)值四個步驟
在組織快速擴(kuò)展的階段,組織需要面對的是新團(tuán)隊(duì)、新員工、新場地(工廠)和新設(shè)備等一個全新的環(huán)境。對于一個新團(tuán)隊(duì),在IP保護(hù)、合規(guī)、質(zhì)量、安全、健康、環(huán)保、安保等方面的要求本身就是一個挑戰(zhàn),同時要達(dá)到快速、高效地完成項(xiàng)目的要求,需要有合適的流程、方法協(xié)助最終達(dá)成目標(biāo)。具體行動實(shí)踐參照后續(xù)“PMO落地實(shí)踐”章節(jié)。
2.2 PMO的落地實(shí)踐
2.2.1 組織內(nèi)部的GMP環(huán)境介紹
1. GMP環(huán)境概述
了解組織內(nèi)部的GMP的生產(chǎn)運(yùn)營環(huán)境是PMO在組織能夠落地的最基礎(chǔ)和重要一步。所在組織內(nèi)部是一個由合規(guī)、審計(jì)、風(fēng)險(xiǎn)、質(zhì)量驅(qū)動的運(yùn)營環(huán)境。
合規(guī)驅(qū)動指的是參照生物制藥行業(yè)的法律、法規(guī)及相關(guān)的指南。相關(guān)參考文件包括:CFDA《計(jì)算機(jī)化系統(tǒng)》附錄、EUGMP附錄11、聯(lián)邦法規(guī)21章11款電子記錄、電子簽名框架結(jié)構(gòu)、ISPE(GAMP5)、EU藥事法規(guī)第4章《文件管理》等。
審計(jì)驅(qū)動指的是由各類官方審計(jì)、客戶審計(jì)等驅(qū)動、指導(dǎo)的生產(chǎn)運(yùn)營過程,如FDA(美國食品藥品管理局)、CFDA(中國食品藥品管理局)、EMA(歐洲藥品管理局)、WHO(世衛(wèi)組織)、客戶審計(jì)(如:GSK、Roche)等。
IP保護(hù)是組織業(yè)務(wù)經(jīng)營秉承的重要原則之一,CMO是為制藥行業(yè)的企業(yè)提供研發(fā)、測試及生產(chǎn)等相關(guān)服務(wù),對IP的保護(hù)是遵守行業(yè)規(guī)則/獲得客戶信任的最基本要求。在服務(wù)過程中,會接觸到客戶的配方、專利等商業(yè)敏感信息,對于客戶信息的保護(hù)及對服務(wù)過程中產(chǎn)生的數(shù)據(jù)信息需要全方位進(jìn)行保護(hù)。從商業(yè)的合同的條款、到實(shí)驗(yàn)人員的培訓(xùn),以及保密合同和組織內(nèi)部IT對信息的嚴(yán)格管控,形成了IP保護(hù)的若干道防火墻。
風(fēng)險(xiǎn)管理保障了組織的運(yùn)營活動,在生物醫(yī)藥企業(yè),風(fēng)險(xiǎn)管理是所有運(yùn)營活動的基礎(chǔ)。由于醫(yī)藥制造行業(yè)的特殊性,任何活動都需要評估風(fēng)險(xiǎn)對病患、生產(chǎn)過程的穩(wěn)定性、產(chǎn)品的質(zhì)量等影響,只有經(jīng)過評估才能執(zhí)行活動,活動結(jié)束后還要進(jìn)行風(fēng)險(xiǎn)再評估和確認(rèn)。
成本和效率是任何組織運(yùn)營必須考慮的問題。在生物制藥行業(yè),其特殊性在于必須符合GMP的要求,要求即成本,如何在合規(guī)性要求下去平衡GMP要求和運(yùn)營效率,是組織面臨的挑戰(zhàn),同樣也是機(jī)遇,因?yàn)樗行袠I(yè)的企業(yè)都需要考慮這樣的平衡。同時組織對成本、效率和合規(guī)平衡的要求,為PMO的生存和發(fā)展提供了契機(jī)。
質(zhì)量是組織的生命線,是賴于生存和發(fā)展的基礎(chǔ)。尤其是在藥企,其產(chǎn)品的使用對象是病患,產(chǎn)品質(zhì)量涉及人的生命安全。因此,在組織內(nèi)部有嚴(yán)格的質(zhì)量控制體系,主要包括研發(fā)的質(zhì)量、生產(chǎn)的質(zhì)量和服務(wù)的質(zhì)量。針對組織內(nèi)部不同的生產(chǎn)經(jīng)營環(huán)節(jié),從上游到下游設(shè)置了不同的質(zhì)量管理控制體系及方法,以保證各環(huán)節(jié)及整體都符合質(zhì)量管理的要求。
2. 常用內(nèi)部質(zhì)量管理方法
在以上多約束條件的GMP運(yùn)營環(huán)境下,在組織內(nèi)部使用嚴(yán)格的質(zhì)量管理手段對所有生產(chǎn)運(yùn)營涉及的操作進(jìn)行管理,常用的質(zhì)量管理方法包括標(biāo)準(zhǔn)操作流程 (Standard Operation Procedure,SOP),偏差管理(Deviation Management,DV),變更控制管理 (Change Control,CC),糾正措施和預(yù)防措施 (Corrective Action Preventive Action,CAPA),風(fēng)險(xiǎn)評估(Risk Assessment), 驗(yàn)證和放行(Validation and Release),周期性回顧(Periodic Review )等。
SOP標(biāo)準(zhǔn)操作流程的制定是對生產(chǎn)運(yùn)營涉及的操作進(jìn)行標(biāo)準(zhǔn)化、規(guī)范化,同時進(jìn)行指導(dǎo),并要求嚴(yán)格遵循和執(zhí)行,如有與標(biāo)準(zhǔn)偏離的情況即判定為偏差(Deviation)。一旦發(fā)現(xiàn)或成為偏差,馬上對偏差造成的對生產(chǎn)過程及產(chǎn)品產(chǎn)生的影響進(jìn)行分類評估,同時對偏差原因進(jìn)行分析,從人、機(jī)、料、法、環(huán)等方面找到根本原因、直接原因,并形成相對應(yīng)的糾正和預(yù)防措施(CAPA)。每一個偏差由指定的部門起草,并和其他相關(guān)部門合作完成調(diào)查、影響分析、原因分析、后續(xù)糾正和預(yù)防措施的指定和完成,并驗(yàn)證效果,由驗(yàn)證和質(zhì)量部門確認(rèn)效果、符合質(zhì)量管理流程并審批后才能關(guān)閉,整個偏差的生命周期才算結(jié)束。質(zhì)量體系管理部門對偏差處理的每個環(huán)節(jié)上(如調(diào)查、原因分析、處理措施執(zhí)行等)都有嚴(yán)格的時間要求,一旦超過了時間,偏差處理本身就形成了偏差,這類偏差同時需要按偏差處理的流程進(jìn)行處理。
關(guān)于變更控制管理(Chang Control,CC)。變更是事物、環(huán)境從一個穩(wěn)態(tài)變化到另一個穩(wěn)態(tài)的過程。在生物制藥行業(yè)中,穩(wěn)態(tài)是一個經(jīng)過驗(yàn)證、風(fēng)險(xiǎn)受控的環(huán)境,從而能夠保證生產(chǎn)過程及產(chǎn)品的穩(wěn)定性。而在一個穩(wěn)態(tài)環(huán)境中加入新的元素,如業(yè)務(wù)需求添加一臺新的設(shè)備,在GMP環(huán)境中就需要進(jìn)入一個新的穩(wěn)態(tài),該環(huán)境要重新進(jìn)行風(fēng)險(xiǎn)評估,根據(jù)風(fēng)險(xiǎn)評估的級別,需要再次驗(yàn)證來確保該新環(huán)境對生產(chǎn)過程和產(chǎn)品無影響或低風(fēng)險(xiǎn)受控。如項(xiàng)目就是一個變更。
關(guān)于數(shù)據(jù)完整性(Data Integration,DI)。數(shù)據(jù)完整性是對制藥行業(yè)的統(tǒng)一、最基本和嚴(yán)格的要求。所有的官方審計(jì)如美國的FDA 審計(jì)、歐盟的EMA審計(jì)、中國SFDA食藥監(jiān)的審計(jì)是必審的環(huán)節(jié)。所有藥品生產(chǎn)過程中產(chǎn)生的數(shù)據(jù)包括系統(tǒng)電子簽名等必須完整可追溯,以確保一旦藥品出了問題,馬上可以查出哪個環(huán)節(jié)出問題。







